La mémoire corporelle représente une notion fascinante, mêlant psychologie et mystère. Elle évoque l'idée que…

En tant que Partenaire Amazon, je réalise un bénéfice sur les achats éligibles.
La thermodynamique est plus qu’une simple branche de la physique. C’est une fenêtre ouverte sur le fonctionnement de notre univers.
Elle étudie les relations entre la chaleur, le travail, et l’énergie, et trouve des applications dans presque tous les domaines de la science et de l’ingénierie.
Imaginez un moteur de voiture, une tasse de café chaud, ou même le fonctionnement de notre planète.
La thermodynamique est là, guidant et expliquant ces phénomènes. Elle nous aide à comprendre comment l’énergie se déplace et se transforme, et comment nous pouvons l’utiliser de manière efficace et responsable.
Dans cet article, nous allons explorer les principes fondamentaux de la thermodynamique. Nous plongerons dans ses lois, ses équations, et ses applications, de l’industrie à l’environnement.
Que vous soyez un étudiant, un professionnel, ou simplement curieux, cet article vous offrira une vue d’ensemble claire et accessible de ce domaine fascinant.
Préparez-vous à un voyage passionnant à travers la chaleur, le travail, et l’énergie. La thermodynamique n’aura plus de secrets pour vous !
Qu’est-ce que la Thermodynamique ?
La thermodynamique est un domaine qui fascine et intrigue, reliant des concepts qui sont au cœur de notre existence.
Mais qu’est-ce que la thermodynamique exactement ? Plongeons dans ses fondements, son rôle et sa terminologie.
Définition et Fondements : Exploration des Origines et des Concepts de Base
La thermodynamique est la science qui étudie les relations entre la chaleur, le travail, et l’énergie. Elle explore comment l’énergie se transforme et se transfère dans l’univers.
Née au 19e siècle, elle a été façonnée par des scientifiques comme Carnot, Joule, et Kelvin.
- Chaleur : Énergie en transit due à une différence de température.
- Travail : Énergie transférée par un système à un autre.
- Énergie : Capacité à effectuer un travail.
Ces concepts sont les piliers de la thermodynamique, guidant tout, des moteurs à vapeur aux réfrigérateurs modernes.
Rôle dans la Science et l’Ingénierie : Importance et Applications
La thermodynamique n’est pas confinée à un laboratoire. Elle joue un rôle vital dans de nombreux domaines :
- Ingénierie : Conception de moteurs, de climatiseurs, et plus encore.
- Chimie : Comprendre les réactions et les liaisons chimiques.
- Biologie : Étudier le métabolisme et les systèmes vivants.
- Environnement : Analyser les impacts climatiques et énergétiques.
Son importance transcende les disciplines, faisant de la thermodynamique un outil essentiel pour les scientifiques et les ingénieurs.
Terminologie Essentielle : Termes et Expressions Clés
La thermodynamique possède un langage propre. Voici quelques termes clés :
- Système : Ce que nous étudions, comme un moteur ou une réaction chimique.
- Environnement : Tout ce qui entoure et interagit avec le système.
- État : La description du système à un moment donné.
- Processus : Comment le système change d’un état à un autre.
Comprendre ces termes est la première étape pour déchiffrer les mystères de la thermodynamique.
En somme, la thermodynamique est une science riche et multidimensionnelle. Elle relie des concepts fondamentaux de notre univers et trouve des applications dans presque tous les domaines de la science et de l’ingénierie. Son langage et ses principes sont les clés pour comprendre notre monde à un niveau plus profond.
Vue d’Ensemble des Principes et Concepts Clés de la Thermodynamique
| Concept | Description | Exemples / Applications |
|---|---|---|
| Premier Principe (Conservation de l’Énergie) | L’énergie ne peut être ni créée ni détruite, seulement transformée. | Conversion de l’énergie thermique en énergie mécanique dans un moteur. |
| Deuxième Principe (Entropie) | L’entropie d’un système isolé ne diminue jamais; elle tend vers un maximum. | Réfrigération, machines thermiques. |
| Troisième Principe (Zéro Absolu) | Il est impossible d’atteindre le zéro absolu (0 Kelvin) en un nombre fini d’étapes. | Explication du comportement des substances à des températures extrêmement basses. |
| Gaz Parfaits | Modèle idéalisé où les particules n’ont pas de volume et n’exercent pas de forces les unes sur les autres. | Équation d’état des gaz parfaits : PV = nRT. |
| Gaz Réels | Modèle plus réaliste tenant compte du volume des particules et des forces intermoléculaires. | Équation de Van der Waals. |
| Cycles Thermodynamiques | Séquence de processus transférant de la chaleur et du travail, revenant à son état initial. | Cycle de Carnot, cycle de Rankine. |
| Équilibre Thermodynamique | État où toutes les propriétés macroscopiques sont constantes dans le temps. | Équilibre dans un système fermé sans échanges de chaleur ou de travail. |
| Technologies Émergentes | Innovations et tendances dans l’application de la thermodynamique. | Énergies renouvelables, cogénération, réfrigération solaire. |
Le Premier Principe : La Conservation de l’Énergie
Le premier principe de la thermodynamique, souvent appelé la loi de la conservation de l’énergie, est un concept fondamental qui régit notre univers.
Il a des implications profondes et des applications pratiques dans de nombreux domaines. Examinons ce principe de plus près.
Compréhension de la Loi Fondamentale
Le premier principe de la thermodynamique stipule que l’énergie ne peut être ni créée ni détruite, seulement transformée d’une forme à une autre.
Cela signifie que la quantité totale d’énergie dans un système isolé reste constante.
- Énergie Interne : La somme de toutes les formes d’énergie dans un système.
- Travail : La manière dont l’énergie est transférée en dehors du système.
- Chaleur : Une autre forme de transfert d’énergie entre systèmes.
Cette loi est un pilier de la physique, et sa compréhension est essentielle pour étudier les systèmes énergétiques.
Exploration de la Conservation de l’Énergie
La conservation de l’énergie a des implications profondes :
- Prévisibilité : Elle permet de prédire le comportement futur d’un système.
- Efficacité : Elle guide la conception de machines plus efficaces.
- Universalité : Elle s’applique à tous les systèmes, des particules aux galaxies.
Cette loi universelle est la clé pour comprendre comment l’énergie se déplace et se transforme.
Exemples Concrets et Pertinents
Le premier principe trouve des applications dans de nombreux domaines :
- Ingénierie : Conception de moteurs et de turbines plus efficaces.
- Médecine : Comprendre le métabolisme et l’énergie dans le corps humain.
- Écologie : Étudier les flux d’énergie dans les écosystèmes.
- Technologie : Développement de batteries et de systèmes d’alimentation.
Ces applications montrent l’importance de la conservation de l’énergie dans notre vie quotidienne.
Le premier principe de la thermodynamique, la conservation de l’énergie, est une loi universelle qui régit notre monde. Sa compréhension permet d’analyser et de prédire le comportement des systèmes énergétiques. Ses applications sont vastes, touchant presque tous les aspects de notre vie, de la technologie à l’écologie. C’est une loi qui, dans sa simplicité, révèle la complexité et la beauté de notre univers.
Le Deuxième Principe : Entropie et Irréversibilité
Le deuxième principe de la thermodynamique, centré sur les concepts d’entropie et d’irréversibilité, est une pierre angulaire de la compréhension moderne de notre univers.
Il guide notre compréhension des machines thermiques et définit les limites de l’efficacité. Penchons-nous sur ce principe fascinant.
Énoncé et Compréhension de l’Entropie : Exploration de Concepts Complexes
L’entropie est souvent décrite comme un degré de désordre ou de chaos dans un système.
Le deuxième principe énonce que, dans un système isolé, l’entropie ne peut jamais diminuer; elle reste constante ou augmente.
- Système Isolé : Un système qui n’échange ni matière ni énergie avec son environnement.
- Augmentation de l’Entropie : Tendance naturelle vers un état plus désordonné.
- Irréversibilité : Processus qui ne peut pas revenir à son état initial.
Ce principe révèle que certains processus sont unidirectionnels, ajoutant une profondeur à notre compréhension de la nature.
Machines Thermiques et Efficacité : Étude des Systèmes et de leur Rendement
Le deuxième principe joue un rôle crucial dans la conception et l’analyse des machines thermiques. Il définit les limites de ce qui est possible en termes d’efficacité.
- Moteurs Thermiques : Ils convertissent la chaleur en travail, mais jamais avec une efficacité de 100%.
- Réfrigérateurs et Pompes à Chaleur : Ils transfèrent la chaleur, mais nécessitent du travail.
- Cycle de Carnot : Un modèle idéalisé qui définit l’efficacité maximale possible.
Voici quelques applications clés :
- Automobiles : Optimisation de la consommation de carburant.
- Climatisation : Conception de systèmes plus économes en énergie.
- Industrie : Amélioration de la production d’énergie.
Ces exemples montrent comment le deuxième principe guide la conception de technologies essentielles.
Le deuxième principe de la thermodynamique, avec ses concepts d’entropie et d’irréversibilité, nous offre une fenêtre sur la nature fondamentale de notre univers. Il définit les limites de l’efficacité et guide la conception de machines thermiques dans de nombreux domaines. C’est une loi qui, bien que complexe, a des implications pratiques et profondes, enrichissant notre compréhension de la science et de la technologie.
Le Troisième Principe : Vers le Zéro Absolu
Le troisième principe de la thermodynamique, bien que moins connu que ses prédécesseurs, est tout aussi fondamental.
Il nous emmène dans un voyage vers le concept mystérieux du zéro absolu, une température où l’agitation moléculaire cesse. Découvrons ce principe et ses implications.
Comprendre le Zéro Absolu et ses Implications
Le troisième principe de la thermodynamique énonce que l’entropie d’un système parfaitement cristallin tend vers zéro à mesure que la température approche du zéro absolu.
En d’autres termes, à cette température limite, un système atteint un état d’ordre parfait.
- Zéro Absolu : Une température de -273,15°C ou 0 Kelvin, où toute agitation thermique cesse.
- Entropie Minimale : À cette température, l’entropie d’un cristal parfait est exactement zéro.
- Inaccessibilité : Bien que nous puissions nous approcher du zéro absolu, l’atteindre est physiquement impossible.
Ce principe nous donne un aperçu des limites ultimes de la nature.
Conséquences Scientifiques : Impact et Applications du Principe
Le troisième principe a des implications profondes dans divers domaines :
- Physique Quantique : À des températures extrêmement basses, les phénomènes quantiques deviennent prédominants.
- Cryogénie : La science des matériaux à très basse température, utilisée dans la recherche médicale et spatiale.
- Superfluidité et Supraconductivité : Des états exotiques de la matière qui n’apparaissent qu’à des températures proches du zéro absolu.
Ces applications montrent comment le troisième principe guide la recherche et la technologie à la frontière de notre compréhension.
Le troisième principe de la thermodynamique nous offre une perspective unique sur les limites ultimes de la température et de l’ordre. Bien que le zéro absolu reste hors de portée, son exploration a ouvert la porte à des découvertes et des innovations révolutionnaires, enrichissant notre compréhension du monde à l’échelle microscopique.
Équations et Propriétés Thermodynamiques
La thermodynamique n’est pas seulement une théorie abstraite; elle s’incarne dans des équations et des propriétés qui décrivent le comportement des substances.
De la modélisation des gaz aux représentations graphiques, cette section explore les aspects mathématiques et visuels de la thermodynamique.
Gaz Parfaits et Réels : Équations d’État et Analyse
Les gaz peuvent être modélisés de différentes manières, en fonction de leur comportement.
- Gaz Parfaits : Ils obéissent à l’équation d’état PV=nRT, où P est la pression, V le volume, n le nombre de moles, R la constante des gaz, et T la température. C’est un modèle idéalisé.
- Gaz Réels : Ils sont décrits par des équations plus complexes, comme l’équation de Van der Waals, qui tient compte des interactions entre particules.
Ces équations sont essentielles pour comprendre et prédire le comportement des gaz.
Relations entre Propriétés Thermodynamiques
Les propriétés thermodynamiques ne sont pas indépendantes; elles sont liées par des équations.
- Lois des Gaz : Comme la loi de Boyle, qui relie pression et volume.
- Relations de Maxwell : Elles connectent différentes dérivées partielles des propriétés thermodynamiques.
- Potentiels Thermodynamiques : Comme l’énergie libre de Gibbs, qui relie l’enthalpie, l’entropie, et la température.
Ces relations sont cruciales pour analyser les systèmes thermodynamiques.
Diagrammes P-V et T-S
Les diagrammes sont des outils puissants pour visualiser les propriétés thermodynamiques.
- Diagramme P-V : Représente la pression contre le volume, utile pour les cycles thermodynamiques.
- Diagramme T-S : Trace la température contre l’entropie, illustrant les transferts de chaleur.
Ces graphiques offrent une compréhension intuitive des processus thermodynamiques.
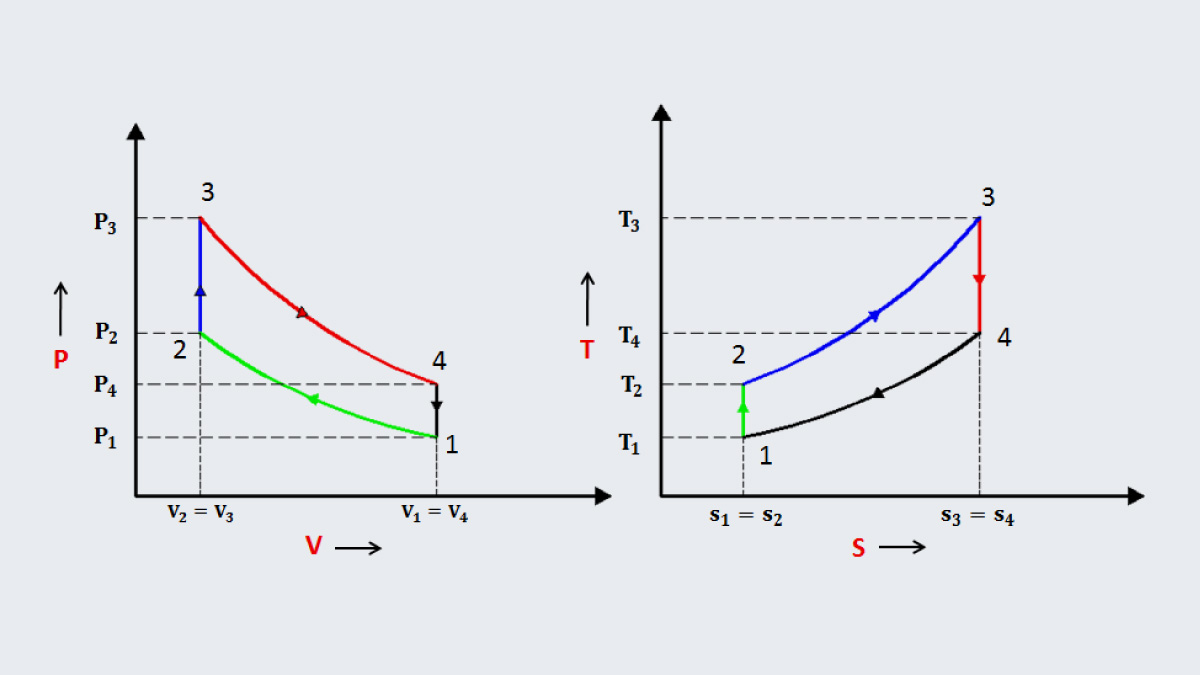
Systèmes et Cycles Thermodynamiques
La thermodynamique, en tant que science de l’énergie et de la chaleur, s’articule autour de systèmes et de cycles bien définis.
Ces éléments sont essentiels pour comprendre comment l’énergie est transformée et utilisée. Plongeons dans la classification des systèmes, les cycles célèbres, et l’évaluation de la performance.
Classification des Systèmes : Types et Contrôle des Volumes
Les systèmes thermodynamiques peuvent être classés en différentes catégories, en fonction de leur interaction avec l’environnement.
- Systèmes Ouverts : Échangent matière et énergie avec l’extérieur.
- Systèmes Fermés : Échangent seulement de l’énergie, pas de matière.
- Systèmes Isolés : Ne permettent ni échange de matière ni d’énergie.
Le contrôle des volumes et la compréhension de ces systèmes sont cruciaux pour l’analyse thermodynamique.
Cycles de Carnot et Rankine
Les cycles thermodynamiques sont au cœur de nombreuses applications, comme les moteurs et les réfrigérateurs.
- Cycle de Carnot : Un modèle idéalisé qui définit l’efficacité maximale possible pour un moteur thermique.
- Cycle de Rankine : Utilisé dans les centrales électriques, il décrit la conversion de la chaleur en travail mécanique.
Ces cycles sont essentiels pour comprendre et optimiser la performance des machines thermiques.
Évaluation de la Performance : Mesure et Optimisation
L’évaluation de la performance est une étape clé dans la conception et l’exploitation des systèmes thermodynamiques.
- Mesure de l’Efficacité : Calcul de la quantité de travail utile par rapport à l’énergie entrante.
- Analyse des Pertes : Identification des sources de perte d’énergie.
- Optimisation : Amélioration de la performance en ajustant les paramètres du système.
Cette évaluation permet de créer des systèmes plus efficaces et durables.
Applications, Environnement et Innovation
La thermodynamique n’est pas confinée aux laboratoires et aux manuels scolaires.
Elle est vivante dans l’industrie, guide notre responsabilité environnementale et inspire les technologies de demain. Explorons ces aspects fascinants de la thermodynamique.
Thermodynamique dans l’Industrie : Utilisations et Avantages
La thermodynamique joue un rôle vital dans divers secteurs industriels.
- Énergie : Optimisation des centrales électriques pour une production plus efficace.
- Automobile : Conception de moteurs plus économes en carburant.
- Alimentation : Contrôle de la température et de la pression dans la transformation des aliments.
Ces applications montrent comment la thermodynamique contribue à une industrie plus performante et compétitive.
Impact et Développement Durable
La thermodynamique est également un outil pour la gestion environnementale.
- Émissions Réduites : Conception de systèmes énergétiques plus propres.
- Utilisation Rationnelle de l’Énergie : Maximisation de l’efficacité pour réduire la consommation.
- Recyclage de la Chaleur : Récupération et réutilisation de la chaleur perdue dans les processus industriels.
Ces stratégies soulignent l’importance de la thermodynamique dans la création d’un avenir plus durable.
Innovations et Tendances Émergentes
La thermodynamique continue d’inspirer les innovations technologiques.
- Énergies Renouvelables : Développement de systèmes solaires et éoliens plus efficaces.
- Stockage d’Énergie : Conception de batteries et de systèmes de stockage thermique avancés.
- Intelligence Artificielle : Utilisation de l’IA pour optimiser les systèmes thermodynamiques.
Ces tendances émergentes montrent que la thermodynamique reste à la pointe de la technologie et de l’innovation.
Énergie Cinétique et Potentielle : Un Aperçu des Transformations Thermodynamiques
Dans le cours de thermodynamique, on étudie souvent les systèmes thermodynamiques et comment l’énergie est échangée entre différentes formes. Prenons l’exemple d’un gaz parfait dans un piston.
- Énergie Cinétique et Molécules : Les molécules d’un gaz sont en mouvement constant. Leur énergie cinétique est liée à leur vitesse. Plus elles se déplacent rapidement, plus l’énergie cinétique est grande.
- Énergie Potentielle et Grandeurs Macroscopiques : L’énergie potentielle est liée aux forces entre les molécules. Elle peut être décrite par des grandeurs macroscopiques comme la pression et le volume.
- Transformations et Théorèmes : Dans une transformation adiabatique (sans échange de chaleur avec le milieu extérieur), la quantité de chaleur échangée est nulle. Le second principe de la thermodynamique nous dit que la variation d’entropie totale dans une transformation réversible est également nulle.
- Coefficients et Capacités Thermiques : La capacité thermique est une mesure de la quantité de chaleur nécessaire pour changer la température. Elle peut être massique (par unité de masse) ou molaire (par quantité de matière).
- Processus Particuliers :
- Isotherme : Température constante.
- Isobare : Pression constante.
- Volume constant : Aucun travail n’est effectué par le système.
- Fonction d’État et Différentielle : La variation d’énergie interne est une fonction d’état. Elle peut être exprimée en termes différentiels et est liée à la capacité calorifique à volume constant.
- Boltzmann et Statistique : La statistique de Boltzmann relie l’entropie à la probabilité microscopique, un concept clé dans la cinétique des gaz.
- Adiabatique et Réversible : Une transformation peut être à la fois adiabatique (sans échange de chaleur) et réversible (sans perte d’énergie).
- Potentielle et Gazeux : L’étude des gaz parfaits permet de comprendre les relations entre l’énergie potentielle et cinétique dans un système gazeux .
Défis et Opportunités : Exploration des Futurs Potentiels
La thermodynamique, loin d’être un chapitre clos de la science, est un domaine vibrant et en constante évolution. Les défis qui se dressent devant nous ne sont pas des obstacles, mais des invitations à explorer, à innover et à transcender.
Imaginez un monde où l’énergie est non seulement abondante mais aussi propre et renouvelable. Un monde où les industries fonctionnent avec une efficacité sans précédent, où les maisons sont chauffées et refroidies sans gaspiller un iota d’énergie.
Ce n’est pas une utopie lointaine, mais une possibilité tangible, guidée par les principes et les pratiques de la thermodynamique.
Encouragement à la Recherche Continue
La thermodynamique n’est pas une science figée; elle est un appel à l’action. Un appel à repousser les limites, à questionner les normes, à briser les barrières.
C’est un appel à vous, lecteur, qu’il s’agisse d’un étudiant curieux, d’un ingénieur passionné, ou d’un citoyen concerné.
La thermodynamique est un langage universel de l’énergie et de la transformation. Elle est un pont entre le passé et l’avenir, une boussole qui nous guide vers un monde meilleur.
Alors, prenons ce flambeau, embrassons ces défis, et marchons ensemble vers un avenir où la thermodynamique n’est pas seulement une théorie, mais une réalité vivante, respirante, et rayonnante.
Dans ce voyage, chaque question est une étape, chaque découverte un jalon, chaque innovation une révolution. La route est longue, mais la destination en vaut la peine. La thermodynamique nous attend, et avec elle, un avenir plein de promesses et de possibilités.
Références et Ressources Complémentaires
La thermodynamique est un domaine riche et complexe qui nécessite une étude approfondie.
Voici quelques ressources essentielles pour ceux qui souhaitent explorer davantage ce sujet fascinant.
1. Les bases de la thermodynamique (de Jean-Noël Foussard, Edmond Julien, Stéphane Mathé et Hubert Debellefontaine)
- Description : Une introduction progressive à la thermodynamique, avec un accent sur les applications concrètes et une approche mathématique simplifiée.
- Nouveautés : Cette édition actualisée comprend des chapitres révisés sur les fluides réels purs et les machines thermiques, ainsi que de nouveaux exercices.
- Utilité : Idéal pour les étudiants débutants, ce livre offre des définitions claires, de nombreux exemples et des exercices corrigés.

2. Le livre Thermodynamique de Richard Taillet
- Description : Un outil de révision précieux, récapitulant les formules, les définitions et les concepts clés de la thermodynamique.
- Caractéristiques : Présenté sous forme de synthèses, avec un index pour une recherche rapide et des « focus » pour des approfondissements sur les points abordés.
- Utilité : Parfait pour contrôler vos connaissances et renforcer votre compréhension des concepts essentiels de la thermodynamique.

3. Thermodynamique : Une approche pragmatique (de Yunus A Cengel, Mehmet Kanoglu et Michael A Boles)
- Description : Une démystification des principes centraux de la thermodynamique, avec une profusion d’exemples concrets et d’applications possibles.
- Caractéristiques : Plus de 2 000 exercices concrets corrigés, 20 textes de vulgarisation scientifique, et un contenu interactif.
- Utilité : Excellent pour les étudiants en thermodynamique, ce livre rend la discipline accessible et couvre un large éventail de notions, des fondements aux applications actuelles.

Ces ressources offrent une variété d’approches et de perspectives sur la thermodynamique, permettant aux lecteurs de choisir celle qui correspond le mieux à leurs besoins et à leurs intérêts.
Que vous soyez un étudiant, un professionnel ou simplement un curieux, ces livres vous fourniront des insights précieux et vous guideront dans votre exploration de la thermodynamique.







Comments (0)