Il existe un élément qui, malgré sa discrétion, joue un rôle clé dans notre quotidien…

En tant que Partenaire Amazon, je réalise un bénéfice sur les achats éligibles.
Quand on parle de métal, on visualise souvent quelque chose de solide, froid et robuste. Pourtant, le monde des métaux est bien plus varié que cela.
Le métal liquide est une preuve vivante que la science a toujours des surprises en réserve.
Ces métaux, uniques dans leur forme et leur fonction, coulent à température ambiante et ouvrent un éventail d’applications passionnantes dans divers domaines.
Plongeons ensemble dans l’univers captivant des métaux liquides et explorons leur potentiel insoupçonné.
Quand on parle de métal, on visualise souvent quelque chose de solide, froid et robuste. Pourtant, le monde des métaux est bien plus varié que cela.
Le métal liquide est une preuve vivante que la science a toujours des surprises en réserve.
Ces métaux, uniques dans leur forme et leur fonction, coulent à température ambiante et ouvrent un éventail d’applications passionnantes dans divers domaines.
Plongeons ensemble dans l’univers captivant des métaux liquides et explorons leur potentiel insoupçonné.
Qu’est-ce qu’un métal liquide ?
Un métal liquide est, comme son nom l’indique, un métal qui se trouve sous forme liquide. Pour y parvenir, il doit être chauffé au-delà de son point de fusion ou être maintenu en état de surfusion.
Toutefois, lorsque nous parlons spécifiquement de métaux liquides, nous faisons généralement référence à ceux qui restent liquides à température ambiante ou à une chaleur légèrement supérieure.
Ces métaux sont rares, mais possèdent des propriétés fascinantes qui les rendent particulièrement intéressants pour diverses applications.
Corps Purs à l’État de Métal Liquide
Dans le vaste univers des métaux, certains se démarquent par leur capacité à rester liquides dans des conditions surprenantes.
Ces corps purs offrent une dimension différente à la science des métaux. Ils ne nécessitent pas une chaleur extrême pour se liquéfier.
Au contraire, leur nature liquide à température ambiante ou légèrement supérieure en fait des phénomènes à part.
Mercure (Hg)
Le mercure, symbolisé par Hg sur le tableau périodique, est unique en son genre.
C’est le seul métal à être naturellement liquide à température ambiante.

Caractéristiques et propriétés
- État à température ambiante : Liquide.
- Point de fusion : -38,8 °C.
- Densité : 13,5 g/cm³, ce qui le rend 13 fois plus dense que l’eau.
- Conductivité : Bon conducteur de l’électricité et de la chaleur.
- Toxicité : Hautement toxique, surtout sous forme de vapeur ou en ingestion.
Usages et applications
- Thermomètres : Auparavant utilisé pour mesurer la température en raison de sa capacité à se dilater de manière uniforme.
- Baromètres : Utilisé pour mesurer la pression atmosphérique.
- Amalgames dentaires : En association avec d’autres métaux pour remplir les cavités.
- Lampes fluorescentes : Le mercure vaporisé émet de la lumière lorsqu’il est excité électriquement.
- Fabrication de produits chimiques : Par exemple, le chlorure de mercure utilisé dans les conservateurs.
Néanmoins, en raison de sa toxicité, l’utilisation du mercure a été réduite dans de nombreux domaines, et des alternatives plus sûres ont été développées.
Il reste cependant un élément fascinant, tant pour ses propriétés uniques que pour son histoire riche en découvertes et en innovations.
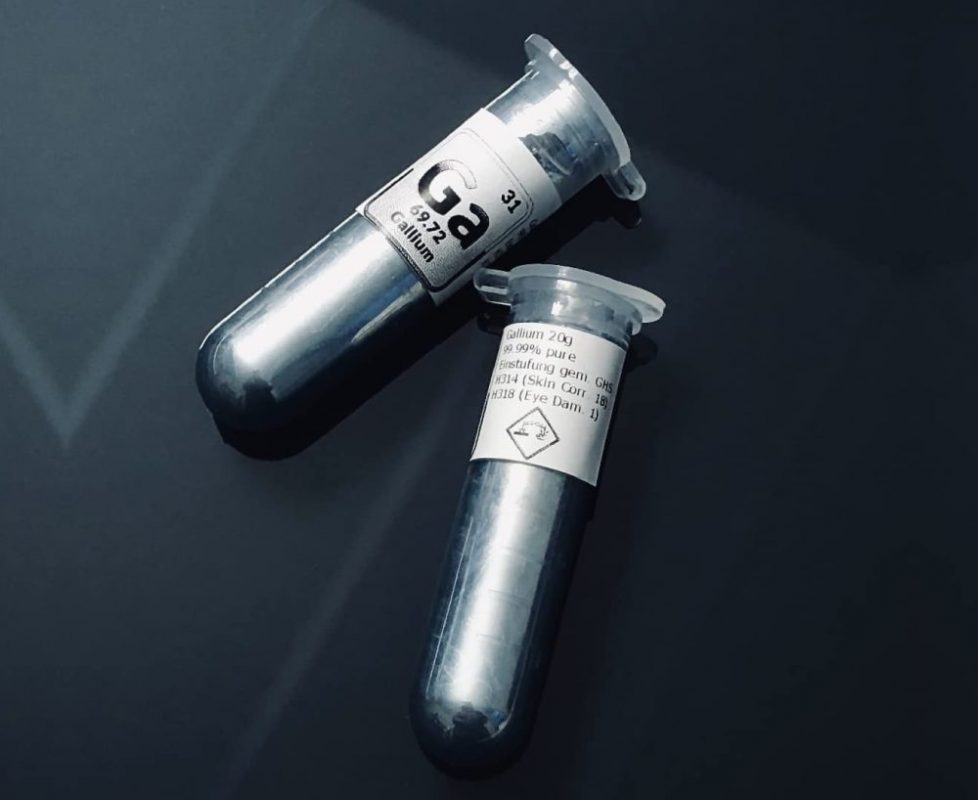
Gallium (Ga)
Le gallium est un métal fascinant, symbolisé par Ga.
Bien qu’il soit solide à température ambiante, il ne lui faut qu’une légère augmentation de température pour passer à l’état liquide.

Propriétés uniques
- Point de fusion bas : Le gallium fond à 29,76 °C. Il peut donc se liquéfier dans la paume de votre main.
- Non-toxique : Contrairement à d’autres métaux, le gallium est considéré comme non-toxique.
- Réactivité : Le gallium peut réagir avec d’autres métaux, modifiant ainsi leurs propriétés.
- Densité faible : Il a une densité plus faible par rapport à d’autres métaux, ce qui lui confère une légèreté relative.
- Résistance à la corrosion : Le gallium est résistant à la corrosion et ne s’oxyde pas facilement à l’air.
Applications modernes dans la technologie
- Semi-conducteurs : En raison de ses propriétés, le gallium est souvent utilisé dans les composants électroniques, en particulier dans les transistors et les diodes.
- Panneaux solaires : Le composé arseniure de gallium est utilisé dans les cellules solaires haut de gamme pour une efficacité accrue.
- LEDs : Le nitride de gallium est un matériau clé pour la production de LEDs bleues et blanches.
- Recherche médicale : Le gallium est utilisé dans certaines procédures d’imagerie médicale et de thérapies.
- Alliages métalliques : Le gallium est utilisé pour créer des alliages avec d’autres métaux, améliorant ainsi leurs caractéristiques.
Avec l’avancement de la technologie, le gallium prend une place de plus en plus importante dans notre vie quotidienne, grâce à ses propriétés uniques et sa polyvalence dans divers domaines technologiques.
Métaux Alcalins
Les métaux alcalins sont reconnus pour leur réactivité élevée, surtout avec l’eau.
Parmi eux, le francium, le césium, et le rubidium se démarquent par leurs propriétés uniques.
Francium (Fr)
- Description : C’est le métal alcalin le plus lourd, et aussi le plus rare.
- Point de fusion : 27 °C.
- Propriétés : Extrêmement radioactif, sa demi-vie est très courte, ce qui le rend difficile à étudier.
- Occurrence : On ne le trouve qu’à l’état de traces dans la nature, principalement dans des minerais d’uranium.
Césium (Cs)
- Description : Métal doux, doré et très réactif.
- Point de fusion : 28,44 °C, ce qui le rend liquide proche de la température ambiante.
- Propriétés : Il est lourd, avec une densité d’environ 1,93 g/cm³.
- Occurrence : Généralement trouvé dans le minerai de lépidolite.
Rubidium (Rb)
- Description : Métal alcalin doux, argenté-blanc.
- Point de fusion : 39,30 °C.
- Propriétés : Il est léger, avec une densité d’environ 1,53 g/cm³.
- Occurrence : Communément trouvé dans les minerais de lépidolite et de leucite.
Réactivité et précautions d’utilisation
- Avec l’eau : Ces métaux réagissent violemment avec l’eau, produisant de l’hydrogène gazeux et des hydroxydes métalliques. Le césium et le rubidium peuvent même s’enflammer lors de cette réaction.
- Avec l’oxygène : Ils réagissent pour former des oxydes. Cette réaction peut être exothermique et dangereuse.
- Stockage : En raison de leur réactivité, ces métaux doivent être stockés sous huile ou dans une atmosphère d’argon pour éviter le contact avec l’humidité ou l’oxygène.
- Manipulation : Doit être effectuée avec soin, en utilisant des équipements de protection appropriés pour éviter les brûlures chimiques ou les incendies.
Transactinides : Flerovium et Copernicium
Au cœur du tableau périodique, on découvre les transactinides, des éléments super lourds.
Parmi eux, le flerovium et le copernicium sont particulièrement intrigants.
Flerovium (Fl)
- Aperçu : Découvert en 1998, il porte le numéro atomique 114.
- Propriétés : Bien qu’il soit prévu que le flerovium soit un métal, son point de fusion calculé de -73 °C suggère qu’il pourrait être liquide à température ambiante.
- Occurrence : C’est un élément synthétique. Il n’est pas naturellement présent sur Terre et doit être produit dans des laboratoires.
Copernicium (Cn)
- Aperçu : Avec le numéro atomique 112, il a été identifié pour la première fois en 1996.
- Propriétés : Son point de fusion est estimé à 10 ± 11 °C, ce qui signifie qu’il est également proche de l’état liquide à température ambiante.
- Occurrence : Tout comme le flerovium, le copernicium est un élément synthétique, produit en laboratoire.
Importance dans la recherche scientifique
- Compréhension de la matière : La création et l’étude de ces éléments offrent des perspectives sur la manière dont les protons et les neutrons interagissent dans les noyaux atomiques.
- Relativité : Ces éléments lourds sont si massifs qu’ils permettent d’observer des effets relativistes sur les électrons. Cela offre une chance unique de vérifier les théories de la relativité dans des conditions extrêmes.
- Nouveaux éléments : La production de transactinides ouvre la voie à la découverte de nouveaux éléments, étendant ainsi notre tableau périodique.
- Applications potentielles : Bien que ces éléments soient instables et de courte durée, comprendre leurs propriétés pourrait conduire à de nouvelles applications inattendues dans le futur.
Alliages de métaux liquides
Les métaux sont fascinants, mais lorsqu’ils se combinent, ils créent des merveilles. Les alliages de métaux liquides représentent cette magie.
Plus qu’une simple fusion de métaux, ces alliages changent la donne en science et en technologie. Ils possèdent des caractéristiques distinctes, des avantages qui surpassent souvent leurs composants individuels.
Que ce soit pour des avancées technologiques ou des applications industrielles, ces alliages s’avèrent être des ressources inestimables.
Alliages du mercure
Composition et caractéristiques
- Amalgames : Le mercure forme facilement des amalgames avec d’autres métaux comme l’argent, l’or et l’étain. Ces mélanges ont des propriétés uniques, souvent exploitées en dentisterie.
- Fluidité : Les alliages de mercure conservent généralement une grande fluidité, ce qui est bénéfique pour certaines applications comme les baromètres.
- Conductivité : Ces alliages, en raison de la présence de mercure, présentent une conductivité thermique et électrique intéressante.
Limitations dues à la toxicité
- Environnement : Le mercure et ses composés sont toxiques pour l’environnement, en particulier les systèmes aquatiques.
- Exposition humaine : La manipulation d’alliages de mercure nécessite des précautions. Une exposition prolongée peut entraîner des problèmes de santé.
- Réglementations : En raison de ces préoccupations, l’utilisation du mercure dans de nombreuses applications a été réglementée ou interdite dans plusieurs pays.
Alliages de l’indium
Caractéristiques et applications
- Point de fusion bas : Les alliages d’indium ont souvent un point de fusion réduit, ce qui les rend utiles dans des applications thermiques spécifiques.
- Ductilité : Ces alliages offrent une excellente ductilité, ce qui facilite leur mise en forme.
- Soudure : Ils sont couramment utilisés comme matériaux de soudure, surtout là où les températures de service sont faibles.
- Écrans tactiles : Grâce à l’oxyde d’indium-étain, certains alliages d’indium jouent un rôle crucial dans les écrans tactiles modernes.
Les défis associés au coût de l’indium
- Ressource limitée : L’indium est rare, ce qui entraîne une augmentation des coûts associés à son extraction et sa production.
- Demande croissante : La demande d’indium dans les secteurs technologiques ne cesse de croître, mettant une pression supplémentaire sur les prix.
- Recherche d’alternatives : Face à ces coûts élevés, les chercheurs explorent des matériaux alternatifs pour remplacer l’indium dans certaines applications.
Alliages du gallium
L’importance croissante des alliages à base de gallium
- Adaptabilité : Les alliages de gallium sont réputés pour leur capacité à s’adapter à diverses applications grâce à leur point de fusion bas et leur non-toxicité relative.
- Électronique : Avec le besoin croissant de composants miniaturisés, les alliages de gallium gagnent en popularité pour leurs excellentes propriétés conductrices.
- Écologie : Leur faible toxicité par rapport à d’autres métaux liquides les rend plus attrayants du point de vue environnemental.
EGaIn et galinstan : propriétés et usages courants
- EGaIn (Eutectique de gallium et d’indium) :
- Propriétés : Hautement conducteur et élastique, EGaIn est stable à l’air et à l’eau.
- Usages : Souvent utilisé dans les circuits électroniques flexibles et la recherche sur les interfaces liquide-solide.
- Galinstan (Gallium, Indium, Étain) :
- Propriétés : Liquide à température ambiante, galinstan est non-toxique et possède une densité élevée.
- Usages : Remplace le mercure dans les thermomètres, utilisé aussi comme agent de refroidissement dans certains systèmes électroniques.
Quelle est la différence entre le mercure et le gallium ?
Le mercure et le gallium diffèrent principalement par leur toxicité et leurs applications. Le mercure est connu pour sa haute toxicité, affectant divers systèmes du corps humain, tandis que le gallium est généralement moins dangereux. Dans le domaine des applications, le mercure, autrefois couramment utilisé dans les thermomètres et les lampes, voit son usage décroître en raison de préoccupations sanitaires et environnementales. Le gallium, quant à lui, est prisé dans le secteur technologique, notamment pour sa capacité semi-conductrice dans les LED.
Peut ont acheter du mercure ou du gallium pour des expériences scientifiques ?
Oui, on peut acheter du mercure et du gallium pour des expériences scientifiques. Cependant, la vente et l'achat de mercure sont strictement réglementés dans de nombreux pays en raison de sa toxicité. Il est généralement acquis auprès de fournisseurs spécialisés en produits chimiques, avec des limitations quantitatives selon les réglementations locales. De son côté, le gallium, moins toxique et prisé pour ses propriétés uniques, est plus accessible et peut être acheté chez des fournisseurs de matériaux pour la recherche ou des boutiques spécialisées en ligne. Dans les deux cas, vous devez respecter les consignes de sécurité lors de leur manipulation.


Comments (0)