Heureusement, créer une bombe atomique n’est pas à la portée du premier venu. Et c’est…
En tant que Partenaire Amazon, je réalise un bénéfice sur les achats éligibles.
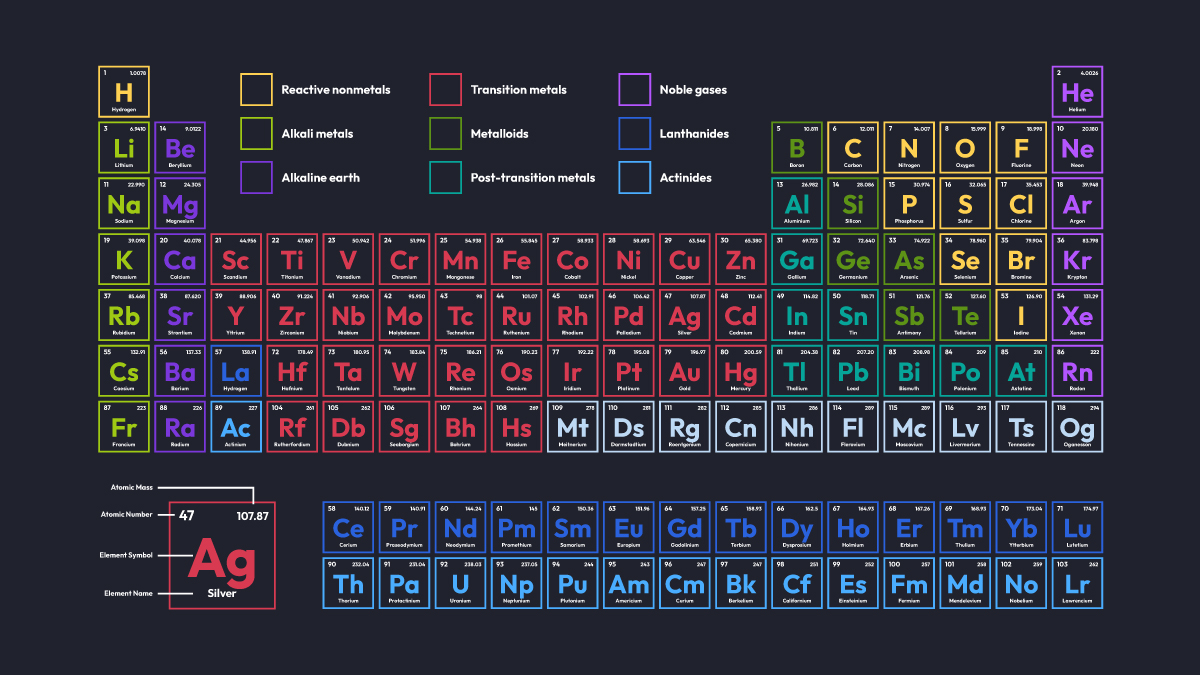
Découvrez la magie du Tableau Périodique des Éléments, une chorégraphie mystérieuse qui dévoile les secrets intimes de la matière.
Ce tableau emblématique est bien plus qu’une simple collection d’éléments ; il nous invite à observer une danse envoûtante entre les atomes, où chaque élément joue son rôle unique et contribue à l’ensemble harmonieux de notre univers.
En plongeant dans ce monde énigmatique, nous serons témoins des liens profonds qui unissent les éléments et de la symétrie complexe qui guide leurs interactions.
Préparez-vous à découvrir les secrets qui résident dans les éléments qui nous entourent.
Qu’est ce que le tableau périodique des éléments ?
Définition
Le Tableau Périodique des éléments est une représentation visuelle intégrale des éléments chimiques.
Ces derniers sont classés en fonction de leur numéro atomique, de leur configuration électronique et de leurs propriétés chimiques.
L’idée maîtresse est de démontrer la périodicité de ces propriétés.
Son origine
Le mérite de la création du Tableau Périodique est généralement attribué à Dmitri Mendeleïev.
Ce chimiste russe a mis au point en 1869 une première version du tableau, bien qu’elle diffère de la nôtre. Cependant, son génie résidait dans la classification systématique des éléments de l’époque.
Sa table a non seulement mis en évidence la périodicité de leurs propriétés chimiques, mais elle a également permis d’identifier les éléments encore inconnus et de prédire certaines de leurs propriétés.
L’évolution du tableau périodique
Le Tableau Périodique a subi de multiples ajustements depuis sa création.
Il a évolué pour devenir le référentiel universel que nous connaissons aujourd’hui.
Il permet d’analyser tous les comportements chimiques et physiques des éléments.
Depuis la dernière mise à jour de l’IUPAC en novembre 2016, le Tableau Périodique standard compte 118 éléments, allant de l’hydrogène (1H) à l’oganesson (118Og).
Utilisation du tableau périodique
Le Tableau Périodique est plus qu’un simple outil pour les chimistes.
C’est une carte universelle des éléments, un point de référence pour comprendre l’univers à un niveau atomique.
- Prédiction des Propriétés : Le Tableau Périodique permet de prédire les propriétés d’éléments encore inconnus.
- Outil d’Enseignement : Il est utilisé pour enseigner et apprendre la chimie.
- Recherche et Développement : Il joue un rôle essentiel dans la recherche de nouveaux éléments et de nouvelles applications.
Le Tableau Périodique est une carte routière essentielle pour la chimie. Il est à la fois un héritage de notre connaissance passé et une boussole pour les découvertes futures. Il incarne la beauté et la complexité de notre univers, du plus petit atome à l’oganesson.
Exploration des Éléments du Tableau Périodique
Pour mieux comprendre le tableau périodique, vous devez vous familiariser avec certains de ses éléments clés.
Passons en revue quelques-uns des éléments les plus remarquables, classés par type.
Éléments Alcalins
Ces éléments sont doux, hautement réactifs et se trouvent généralement dans la nature sous forme de sels.
- Hydrogène (H): Élément le plus léger et le plus abondant de l’univers, il est inflammable.
- Lithium (Li): Utilisé dans les batteries en raison de sa légèreté et de sa douceur.
- Sodium (Na): Essentiel pour la vie, il réagit violemment avec l’eau.
- Potassium (K): Joue un rôle crucial dans le fonctionnement cellulaire et réagit fortement avec l’eau.
- Rubidium (Rb): Un métal doux et argenté, il est hautement réactif.
- Césium (Cs): De couleur dorée, on l’utilise dans les horloges atomiques.
- Francium (Fr): Élément radioactif et rare, il a été découvert en France.
Éléments Alcalino-Terreux
Ces éléments sont plus durs que les alcalins mais restent hautement réactifs.
- Béryllium (Be): Dur, il a un point de fusion élevé et est utilisé en aéronautique.
- Magnésium (Mg): Léger et combustible, on l’utilise dans les alliages.
- Calcium (Ca): Dur et essentiel à la vie, il est présent dans les os.
- Strontium (Sr): Doux et argenté, on l’utilise en feux d’artifice.
- Baryum (Ba): Lourd et toxique, il est utilisé en radiologie.
- Radium (Ra): Radioactif et luminescent, il a été découvert par les Curie.
Métaux de Transition
Ces éléments sont caractérisés par leur dureté et leur résistance, ainsi que par leur utilisation dans diverses industries.
- Scandium (Sc): Rare, il est utilisé dans certains alliages.
- Titane (Ti): Résistant et léger, on l’utilise en chirurgie.
- Vanadium (V): Dur, il est utilisé pour renforcer l’acier.
- Chrome (Cr): Brillant et résistant à la corrosion, il est utilisé en plomberie.
- Manganèse (Mn): Dur, il est utilisé dans les piles alcalines.
- Fer (Fe): Abondant et essentiel à la vie, il est utilisé en construction.
- Cobalt (Co): Magnétique, il est utilisé dans les aimants et les batteries rechargeables.
- Nickel (Ni): Résistant à la corrosion, on l’utilise dans les pièces de monnaie et les bijoux.
- Cuivre (Cu): Un excellent conducteur électrique, il est utilisé dans les câbles et les circuits imprimés.
- Zinc (Zn): Anti-corrosion, il est utilisé pour galvaniser et fabriquer des piles.
- Rhodium (Rh): Précieux, on l’utilise pour plaquer les bijoux et les contacts électriques.
- Palladium (Pd): Catalyseur, utilisé dans les convertisseurs catalytiques et la joaillerie.
- Argent (Ag): Brillant, conducteur, utilisé dans la monnaie et les bijoux.
- Cadmium (Cd): Toxique, utilisé dans les batteries et les revêtements.
- Indium (In): Souple, utilisé dans les écrans LCD et les cellules solaires.
- Étain (Sn): Malléable, utilisé pour l’étainage des boîtes de conserve et les alliages.
- Iridium (Ir): Dense, utilisé dans les pointes de stylo et les bougies d’allumage.
- Platine (Pt): Précieux, utilisé dans les bijoux, les catalyseurs et les enregistrements sonores.
- Or (Au): Précieux, utilisé dans la joaillerie, les réserves de valeur et l’électronique.
- Mercure (Hg): Liquide argenté, toxique, utilisé dans les thermomètres et les lampes fluorescentes.
- Rutherfordium (Rf): Élément synthétique, on l’utilise en recherche scientifique.
Non-Métaux
Ces éléments sont généralement moins denses que les métaux, avec des propriétés variées.
- Soufre (S): Jaune, avec une odeur caractéristique, il est utilisé dans les produits chimiques et les explosifs.
- Chlore (Cl): Gaz vert piquant, on l’utilise pour la désinfection et la purification de l’eau.
- Fluor (F): Réactif, utilisé dans les dentifrices et les revêtements antiadhésifs.
- Oxygène (O): Essentiel à la vie, on l’utilise dans la respiration et l’oxydation.
- Azote (N): Abondant dans l’atmosphère, utilisé dans les engrais et les explosifs.
Halogènes
Ces éléments sont des non-métaux très réactifs qui existent sous plusieurs états physiques à température ambiante.
- Iode (I): Solide violet, on l’utilise dans les désinfectants et les produits médicaux.
- Brome (Br): Liquide rouge, on l’utilise dans les retardateurs de flamme et les produits chimiques.
- Chlore (Cl): Gaz vert piquant, utilisé pour la désinfection et la purification de l’eau.
- Fluor (F): Réactif, utilisé dans les dentifrices et les revêtements antiadhésifs.
- Astate (At): Radioactif, on l’utilise en recherche médicale.
Gaz Nobles
Ces éléments sont incolores, inodores, insipides, et non réactifs dans la plupart des conditions.
- Hélium (He): Non réactif, utilisé dans les ballons et la cryogénie.
- Néon (Ne): Lumineux, utilisé dans les enseignes lumineuses et les lasers.
- Argon (Ar): Inerte, on l’utilise pour remplir les ampoules électriques et les chambres à atmosphère contrôlée.
- Krypton (Kr): Incolore, utilisé dans les lampes à éclairage intensif et les lasers.
- Xénon (Xe): Inodore, utilisé dans les lampes flash et les tubes à rayons X.
Lanthanides
Ces éléments, souvent appelés « terres rares », ont des utilisations diverses dans l’industrie et la technologie.
- Lanthane (La): Réactif, utilisé dans les alliages d’acier et les piles.
- Cérium (Ce): Réactif, utilisé dans les convertisseurs catalytiques et les verres spéciaux.
- Praséodyme (Pr): Magnétique, on l’utilise dans les aimants permanents et les lasers.
- Néodyme (Nd): Puissant aimant, utilisé dans les aimants permanents et les haut-parleurs.
- Prométhium (Pm): Radioactif, utilisé en sources de chaleur et en recherche médicale.
Actinides
Ces éléments sont tous radioactifs et sont souvent utilisés en recherche scientifique et dans l’industrie nucléaire.
- Thorium (Th): Radioactif, utilisé dans les réacteurs nucléaires et en recherche scientifique.
- Protactinium (Pa): Radioactif, on l’utilise en recherche scientifique et en médecine.
- Uranium (U): Radioactif, utilisé comme combustible dans les réacteurs nucléaires.
- Neptunium (Np): Radioactif, utilisé en recherche scientifique et en médecine.
- Plutonium (Pu): Radioactif, on l’utilise dans les armes nucléaires et les réacteurs nucléaires.
Éléments Transuraniens
Ces éléments, tous synthétiques, sont radioactifs et sont principalement utilisés en recherche scientifique.
- Américium (Am): Radioactif, on l’utilise dans les détecteurs de fumée et les sources de rayonnement.
- Curium (Cm): Radioactif, utilisé en recherche scientifique et en médecine.
- Berkélium (Bk): Radioactif, utilisé en recherche scientifique et en médecine.
- Californium (Cf): Radioactif, on l’utilise en recherche scientifique et en médecine.
- Einsteinium (Es): Radioactif, utilisé en recherche scientifique et en médecine.
Éléments Non Classés
Ces éléments, qui se trouvent généralement à la fin du tableau périodique, sont principalement radioactifs et sont principalement utilisés en recherche scientifique.
- Fermium (Fm): Radioactif, on l’utilise en recherche scientifique et en médecine.
- Mendélévium (Md): Radioactif, utilisé en recherche scientifique et en médecine.
- Nobelium (No): Radioactif, utilisé en recherche scientifique et en médecine.
- Lawrencium (Lr): Radioactif, on l’utilise en recherche scientifique et en médecine.
- Rutherfordium (Rf): Élément synthétique, utilisé en recherche scientifique.
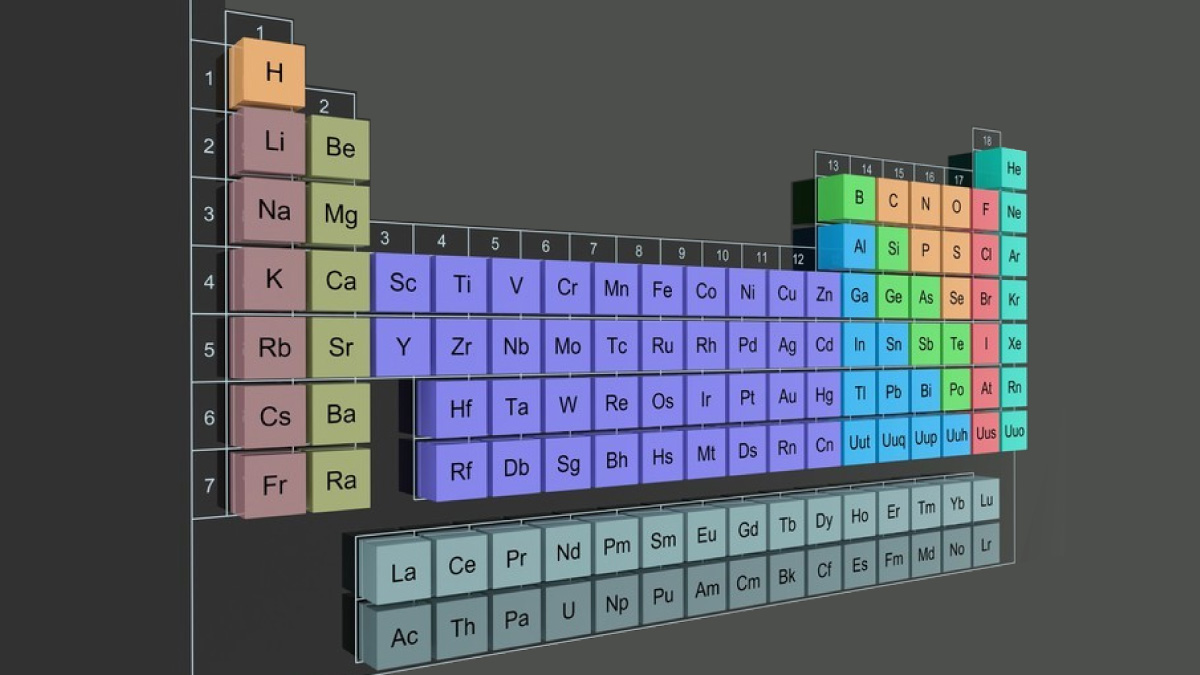
Comprendre la structure du tableau périodique
Chaque case représente un élément unique, avec des informations clés, comme le nom, le numéro atomique et le poids atomique.
Il se divise en quatre blocs : s, p, d et f, basés sur l’orbite électronique finale. Les éléments de chaque bloc partagent des caractéristiques communes.
Le tableau périodique dans l’art et la culture
On retrouve le tableau périodique au-delà de la science. Il est apparu dans l’art, la musique et la culture pop, devenant une icône de la connaissance scientifique.
Des auteurs ont utilisé le tableau périodique comme source d’inspiration. Par exemple, Primo Levi a écrit « Le Système périodique », un recueil de nouvelles basé sur les éléments chimiques.
L’importance pédagogique du tableau périodique
Le tableau périodique n’est pas qu’un simple outil pour les chimistes. Il s’avère être un excellent support pédagogique.
Éveiller la curiosité scientifique
Découvrir le tableau périodique peut éveiller l’intérêt pour la science chez les jeunes esprits.
Les éléments variés et leurs propriétés uniques peuvent susciter la curiosité et stimuler l’imagination.
Comprendre la nature de la matière
Le tableau périodique aide à comprendre la nature fondamentale de la matière.
Il montre comment les éléments s’organisent, interagissent et forment le monde autour de nous.
Tableau périodique des éléments Complets (simplifié)
| 1 H | 2 He | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 3 Li | 4 Be | 5 B | 6 C | 7 N | 8 O | 9 F | 10 Ne | ||||||||||
| 11 Na | 12 Mg | 13 Al | 14 Si | 15 P | 16 S | 17 Cl | 18 Ar | ||||||||||
| 19 K | 20 Ca | 21 Sc | 22 Ti | 23 V | 24 Cr | 25 Mn | 26 Fe | 27 Co | 28 Ni | 29 Cu | 30 Zn | 31 Ga | 32 Ge | 33 As | 34 Se | 35 Br | 36 Kr |
| 37 Rb | 38 Sr | 39 Y | 40 Zr | 41 Nb | 42 Mo | 43 Tc | 44 Ru | 45 Rh | 46 Pd | 47 Ag | 48 Cd | 49 In | 50 Sn | 51 Sb | 52 Te | 53 I | 54 Xe |
| 55 Cs | 56 Ba | Lanthanides 57-71 |
72 Hf | 73 Ta | 74 W | 75 Re | 76 Os | 77 Ir | 78 Pt | 79 Au | 80 Hg | 81 Tl | 82 Pb | 83 Bi | 84 Po | 85 At | 86 Rn |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 87 Fr | 88 Ra | Actinides 89 – 103 |
104 Rf | 105 Db | 106 Sg | 107 Bh | 108 Hs | 109 Mt | 110 Ds | 111 Rg | 112 Cn | 113 Nh | 114 Fl | 115 Mc | 116 Lv | 117 Ts | 118 Og |
| 57 La | 58 Ce | 59 Pr | 60 Nd | 61 Pm | 62 Sm | 63 Eu | 64 Gd | 65 Tb | 66 Dy | 67 Ho | 68 Er | 69 Tm | 70 Yb | 71 Lu |
|---|
| 89 Ac | 90 Th | 91 Pa | 92 U | 93 Np | 94 Pu | 95 Am | 96 Cm | 97 Bk | 98 Cf | 99 Es | 100 Fm | 101 Md | 102 No | 103 Lr |
|---|
Les Mystères des Éléments Chimiques
Les éléments chimiques sont fascinants. Parmi les 118 éléments connus, 83 d’entre eux sont considérés comme primordiaux. Leur existence prédate notre Terre grâce à la stabilité de leurs isotopes. Trois d’entre eux, l’uranium (92U), le thorium (90Th) et le bismuth (83Bi), sont radioactifs, bien que la radioactivité du bismuth soit si faible qu’elle n’a été découverte qu’en 2003.
Nature, Radioactivité et Création d’Éléments
Onze de ces éléments, bien qu’existant naturellement sur Terre, sont trop radioactifs pour avoir survécu depuis la création du Système solaire. Ils sont constamment générés par la désintégration radioactive d’autres éléments, principalement l’uranium et le thorium. Par exemple, le technétium (43Tc), l’élément le plus léger de ce groupe, provient de la fission de l’uranium. Le plutonium (94Pu), l’élément le plus lourd, est un radioisotope naturel trouvé en traces dans la pechblende, un minerai d’uranium majeur.
Les Éléments Synthétiques
En plus des éléments naturels, nous avons également des éléments synthétiques. Ces 24 éléments n’existent pas naturellement sur Terre, mais sont produits artificiellement dans les réacteurs nucléaires ou en laboratoire. Certains d’entre eux peuvent cependant être trouvés dans la nature à la suite d’essais nucléaires atmosphériques ou d’accidents nucléaires.
État Standard des Éléments
L’état standard des éléments à température et pression normales (0 °C et 1 atm) est un autre aspect fascinant. Sur les 103 éléments dont l’état standard est connu, 90 sont solides, 11 sont gazeux, et seulement deux sont liquides : le brome (35Br) et le mercure (80Hg).
Conception du Tableau Périodique
Le tableau périodique, qui organise ces éléments, est une merveille de conception scientifique. Chaque ligne, ou période, du tableau correspond à une couche électronique. Ces couches, identifiées par leur nombre quantique principal, n, sont au nombre de sept dans le tableau standard. Chaque période est ensuite divisée en un à quatre blocs, correspondant aux sous-couches électroniques, identifiées par leur nombre quantique secondaire, ℓ. Enfin, chaque sous-couche contient un certain nombre d’orbitales atomiques, chacune pouvant être occupée par au plus deux électrons.
Le monde des éléments chimiques est un univers complexe et fascinant, plein de mystères et de découvertes scientifiques passionnantes.
L’Essence du Numéro Atomique
Le numéro atomique, également désigné par la lettre Z, est une identification unique attribuée à chaque élément chimique. Il est synonyme du type d’atome spécifique en question.
Un Aperçu de Base
Au cœur de chaque atome, le numéro atomique est égal au nombre de protons. C’est une constante qui ne varie jamais, peu importe les conditions. Par exemple, le numéro atomique de l’oxygène est 8, ce qui signifie que chaque atome d’oxygène comporte 8 protons.
Numéro Atomique et Électrons
Dans un atome neutre, le nombre de protons est équivalent au nombre d’électrons. De ce fait, le numéro atomique peut également indiquer le nombre d’électrons pour ces atomes. Cependant, il est important de noter que lorsqu’un atome se transforme en ion, le nombre de protons et d’électrons devient différent. Par conséquent, le numéro atomique ne doit pas être utilisé pour déterminer le nombre d’électrons.
Unicitivité de l’Élément
Chaque élément se distingue par son propre numéro atomique. En d’autres termes, si nous changeons le numéro atomique, nous changeons d’élément. Ceci est dû au fait que le nombre de protons est unique à chaque substance.
Une Règle Sans Exception
Il n’y a aucune exception à cette règle du numéro atomique. Le nombre de protons dans un atome définit son identité élémentaire, faisant du numéro atomique une caractéristique absolue et inaltérable.
Le numéro atomique joue un rôle crucial dans la classification et l’identification des éléments chimiques. Il offre une perspective fondamentale sur la nature et la structure des atomes.
Périodes et Périodicité des Propriétés
La périodicité des propriétés dans le tableau périodique dénote la régularité des propriétés chimiques et physiques des éléments d’une période à l’autre. Notons que ces propriétés chimiques ne restent pas constantes au sein d’une même période.
La Masse Atomique
La masse atomique est la somme des masses de tous les constituants d’un atome, à savoir les protons, les neutrons et les électrons. Dans une période, la masse atomique augmente de gauche à droite, tout comme le nombre de particules atomiques. En suivant le même principe, au sein d’une famille, la masse atomique augmente de haut en bas.
Le Rayon Atomique
Le rayon atomique correspond à la distance entre le centre de l’atome et sa périphérie. Un plus grand rayon atomique implique un volume atomique plus important. Au sein d’une période, le rayon atomique augmente de droite à gauche, alors que dans une famille, il augmente de haut en bas.
L’Électronégativité
L’électronégativité est une mesure de la capacité d’un atome à attirer des électrons lorsqu’il forme une liaison chimique. Une plus grande électronégativité signifie une plus grande capacité à capter des électrons. Dans une période, l’électronégativité augmente de gauche à droite, et dans une famille, elle augmente de bas en haut.
Notez que les gaz inertes n’ont pas d’électronégativité car ils ne cherchent pas à gagner d’électrons, leur dernière couche électronique étant déjà saturée.
L’Énergie d’Ionisation
L’énergie d’ionisation est l’énergie nécessaire pour retirer un électron d’un atome. Plus cette énergie est élevée, plus il est difficile d’arracher un électron à l’atome. Dans une période, l’énergie d’ionisation augmente de gauche à droite. Dans une famille, elle augmente du bas vers le haut.
Compréhension de la Masse Atomique
La masse atomique est la masse totale d’un atome. Cette masse se mesure généralement en unités de masse atomique (u) ou en grammes (g). Elle tient compte de la somme des masses des protons et neutrons qui composent le noyau de l’atome. Les électrons, beaucoup plus légers (environ 2000 fois), ne sont pas pris en compte car leur impact sur la masse totale est minime.
Masse des Particules Subatomiques
| Particule | Masse (g) |
|---|---|
| Neutron | 1,675×10−24 |
| Proton | 1,673×10−24 |
| Électron | 9,109×10−28 |
Unité de Masse Atomique
En pratique, on utilise l’unité de masse atomique (u) pour faciliter les calculs, car les valeurs de masse en grammes sont très petites. Par convention, 1 u est égale à 1,66×10−24 g, ce qui correspond au douzième de la masse atomique du carbone.
Isotopes et Nombre de Masse
Un atome est caractérisé par son numéro atomique (Z) et son nombre de masse (A). Le nombre de masse est la somme des protons et neutrons dans le noyau. De nombreux éléments existent sous plusieurs formes, ou isotopes, qui ont le même numéro atomique mais un nombre de neutrons différent.
Isotopes Radioactifs
Un isotope radioactif est un isotope dont le noyau est instable et se dégrade en émettant de l’énergie. Ces isotopes peuvent être naturels ou artificiels, et leur radioactivité peut être utilisée à des fins diverses, y compris le traitement du cancer, la fabrication de détecteurs de fumée, et la production d’électricité.
Masse Atomique Moyenne
La masse atomique moyenne est une moyenne pondérée des masses atomiques de tous les isotopes d’un élément, en fonction de leur abondance naturelle. Cette valeur se trouve généralement dans le tableau périodique.
Par exemple, la masse atomique moyenne du béryllium dans le tableau périodique est de 9,01 u. Notez que le format des tableaux périodiques peut varier, donc la position de cette valeur peut changer.
Calcul de la Masse Atomique Moyenne
La formule suivante peut être utilisée pour calculer la masse atomique moyenne :
¯¯¯¯¯m=(%isotope 1×misotope 1)+(%isotope 2×misotope 2)+…
où ¯¯¯¯¯m représente la masse atomique moyenne d’un élément, %isotope 1 représente l’abondance naturelle de l’isotope 1, misotope 1 représente la masse atomique relative de l’isotope 1, %isotope 2 représente l’abondance naturelle de l’isotope 2, et ainsi de suite pour tous les isotopes de l’élément.
Exploration des Périodes dans le Tableau Périodique
Une période est une rangée horizontale dans le tableau périodique des éléments. Ces périodes sont numérotées de un à sept de haut en bas, le numéro de la période étant généralement indiqué sur le côté gauche du tableau.
Les Lanthanides et les Actinides
Il est important de noter que les lanthanides (éléments 58 à 71) et les actinides (éléments 90 à 103) appartiennent respectivement aux périodes 6 et 7.
Périodes et Modèle Atomique de Rutherford-Bohr
La division des éléments en sept périodes distinctes nous aide à déterminer facilement le nombre de niveaux d’énergie, ou couches électroniques, d’un élément. C’est particulièrement utile pour la représentation des atomes selon le modèle atomique de Rutherford-Bohr.
Comprendre le Modèle Atomique de Rutherford-Bohr
Dans le modèle de Rutherford-Bohr, l’atome est constitué d’un noyau central massif et dense contenant des protons, autour duquel les électrons se déplacent sur des couches électroniques. Plus un atome a d’électrons, plus il a de couches électroniques.
Pour comprendre ce modèle dans son contexte historique et en savoir plus sur les différents modèles atomiques, vous pouvez vous référer à des ressources supplémentaires sur l’histoire du modèle atomique.
Périodes et Couches Électroniques
Le nombre de couches électroniques d’un élément correspond au numéro de sa période dans le tableau périodique. Par exemple, l’hélium, qui a une seule couche électronique, appartient à la première période. Le bore, avec deux couches électroniques, appartient à la deuxième période. De même, le calcium, avec quatre couches électroniques, appartient à la quatrième période.
Distribution des Électrons sur les Couches Électroniques
Les électrons d’un atome sont répartis sur ses différentes couches électroniques. La manière dont ils sont distribués dépend de la capacité maximale de chaque couche. Ainsi, les couches les plus proches du noyau sont remplies en premier.
De plus, le nombre d’éléments dans une période du tableau périodique correspond au nombre maximal d’électrons que peut contenir cette couche électronique. Cependant, cette règle s’applique principalement aux éléments 1 à 20. Pour les éléments à partir du numéro atomique 21, d’autres théories sont plus appropriées pour représenter la structure atomique.
L’art de l’organisation électronique : la règle de Klechkowski revisitée
La règle de Klechkowski est la clé pour comprendre la structure des atomes. Malgré son importance, cette règle peut sembler complexe à première vue. Pourtant, une fois déchiffrée, elle révèle un schéma organisé et prévisible d’occupation des électrons autour de l’atome.
La logique cachée de l’organisation électronique
Chaque atome dispose d’un ensemble de couches électroniques. Ces couches ne sont pas toutes remplies au cours d’une même période. En fait, à partir de la 3e période, des sous-couches de différentes couches se remplissent simultanément.
La distribution des électrons suit le principe d’Aufbau, ou principe de « construction » en allemand. Ce principe, combiné à la règle de Klechkowski, dicte l’ordre précis de remplissage des sous-couches électroniques. Selon cette règle, les sous-couches se remplissent de sorte que les valeurs de n + ℓ, puis n, augmentent progressivement. Ici, n est le nombre quantique principal, et ℓ est le nombre quantique azimutal.
Exceptions et règle de Hund
La règle de Klechkowski s’applique dans plus de 80% des cas. Cependant, une vingtaine d’éléments y dérogent. Pour ces exceptions, la configuration la plus stable (et donc la plus énergétiquement favorable) n’est pas celle qui suit la règle de Klechkowski.
Cela est principalement dû à la règle de Hund, qui stipule que la configuration la plus stable pour une orbitale atomique est celle qui maximise le spin total des électrons. Pour certains éléments du bloc d et du bloc f (métaux de transition, lanthanides et actinides), il est moins énergétique de suivre la règle de Klechkowski que de favoriser l’occupation impaire des sous-couches les plus externes lorsque la couche d ou f est vide, à moitié remplie ou entièrement remplie.
L’importance de la périodicité dans les propriétés chimiques
La classification périodique des éléments a le mérite d’organiser les éléments de manière à ce que leurs propriétés physico-chimiques puissent être largement prédites par leur position dans le tableau. Ces propriétés évoluent différemment selon qu’on se déplace verticalement ou horizontalement dans le tableau.
En bref, la règle de Klechkowski est une règle essentielle pour comprendre la structure atomique. Mais elle n’est pas absolue, et certaines exceptions, guidées par la règle de Hund, existent. Tout cela contribue à la richesse et à la complexité du monde atomique qui sous-tend notre réalité matérielle.
Téléchargez Votre Tableau Périodique des Éléments
Ressource précieuse pour les physiciens et les curieux
Ne laissez pas votre apprentissage des éléments se limiter à votre écran. Nous avons préparé pour vous un tableau périodique des éléments en PDF de haute qualité. Avec cela, vous aurez tous les éléments, de l’hydrogène au germanium, du silicium au polonium, à portée de main.
Accédez à vos informations où que vous soyez
Que vous soyez un étudiant en physique, un enseignant, ou simplement un passionné de science, ce tableau périodique est un excellent outil pour enrichir vos connaissances. Téléchargez-le et consultez-le à tout moment, même hors ligne.
Téléchargez votre Tableau Périodique des Éléments gratuitement
Prêt à explorer le monde des éléments ? Cliquez sur le bouton ci-dessous pour télécharger le tableau périodique des éléments en PDF. L’aventure de la découverte vous attend.
Nous espérons que ce tableau vous sera utile et vous aidera à comprendre les merveilles du monde atomique, depuis les noyaux les plus stables jusqu’aux éléments lourds les plus instables. Bon voyage dans le monde de la physique!
Conclusion : La Magie du Tableau Périodique des Éléments
Les physiciens ont créé le tableau périodique, une véritable table des éléments, pour classer tous les éléments. Cette classification des éléments repose sur leur nombre atomique, soit le nombre de nucléons dans le noyau atomique. Les éléments lourds, comme le polonium, ont plus de nucléons que des éléments plus légers comme le silicium.
Chaque atome de carbone, comme tous les autres éléments, a un noyau atomique. Autour du noyau, la structure électronique est disposée en couches. Les ions sont des atomes ayant une charge électrique. Cela se produit quand ils gagnent ou perdent des électrons dans leur couche externe.
Les liaisons se forment entre les atomes pour créer des molécules. Lorsque les atomes forment ces liaisons, ils peuvent devenir plus stables. Cependant, certains éléments sont instables. C’est le cas du deutérium, un isotope du germanium.
Les éléments qui possèdent le même nombre de protons, c’est-à-dire le même nombre atomique, sont regroupés sous le même symbole chimique dans le tableau de classification. C’est pourquoi, malgré leurs différences de masse, ils possèdent les mêmes propriétés.
Enfin, les propriétés physiques des éléments sont liées à leur structure électronique. Les éléments avec une charge positive dans leur noyau, par exemple, sont électriquement stables.
Le tableau périodique des éléments est donc une véritable carte du monde atomique, un outil précieux pour tout physicien et un incontournable dans l’étude de la matière.





Comments (0)