En théorie des probabilités, la loi arc sinus est une loi de probabilité à densité…
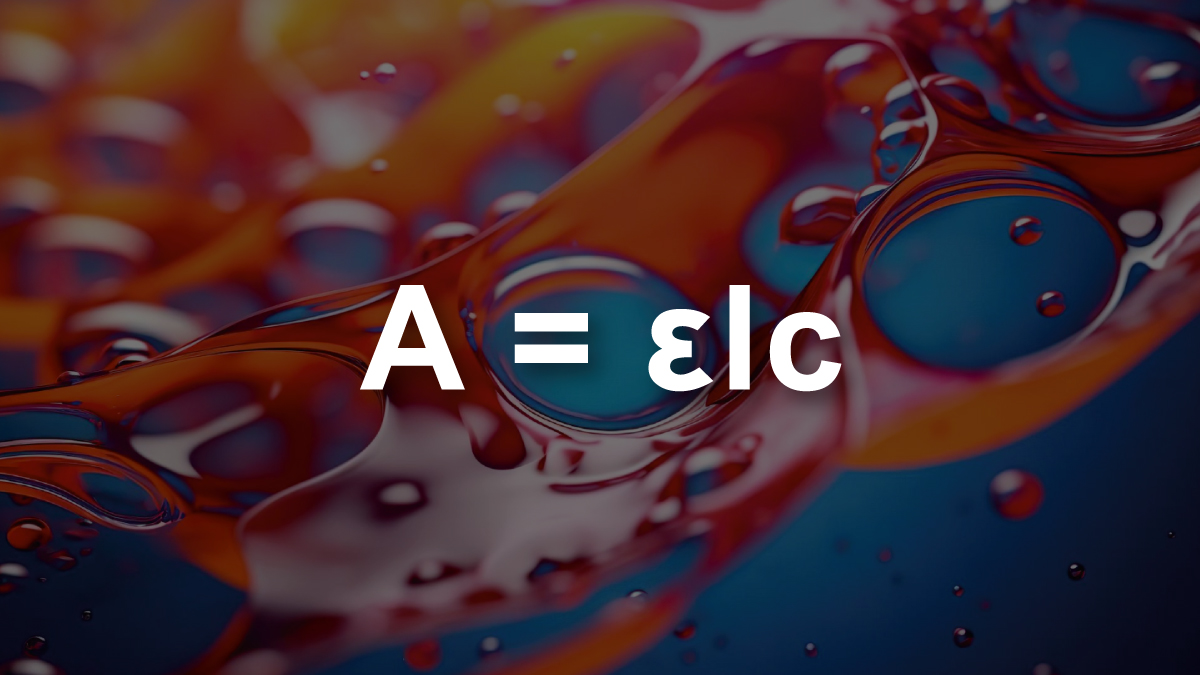
La loi de Beer-Lambert établit un lien fondamental entre l’absorbance d’une solution et ses propriétés physico-chimiques.
En spectrophotométrie, cette loi permet de mesurer la quantité de lumière absorbée par une solution, offrant ainsi une méthode précise pour déterminer la concentration des substances dissoutes.
Selon cette loi, l’absorbance est directement proportionnelle à la concentration de l’espèce absorbante et à la longueur du trajet que la lumière parcourt dans la solution.
Principalement utilisée en chimie analytique, la loi de Beer-Lambert joue un rôle crucial dans les domaines de la recherche biomédicale, environnementale et des matériaux.
Son application aide à analyser des échantillons de manière non destructive, fournissant des données essentielles pour de nombreuses analyses qualitatives et quantitatives.
Qu’est-ce que la loi de Beer-Lambert ?
Définition de la loi de Beer-Lambert
La loi de Beer-Lambert est une relation mathématique qui relie l’absorbance d’une solution à la concentration de ses constituants absorbants et à la longueur du trajet lumineux à travers cette solution.
Utilisée en spectrophotométrie, elle permet de déduire la concentration d’une substance en mesurant la quantité de lumière qu’elle absorbe.
Cette loi est essentielle dans de nombreux domaines scientifiques, notamment la biochimie, l’écologie, et la pharmacologie, où elle aide à analyser des substances variées de manière précise et non destructive.
Aperçu historique
La découverte initiale revient à Pierre Bouguer en 1729, qui a observé cette relation en étudiant la lumière à travers du vin rouge. Jean-Henri Lambert a ensuite élargi le concept en 1760, en introduisant la notion que l’absorbance est proportionnelle à l’épaisseur du milieu.
En 1852, August Beer a complété cette théorie en liant l’absorbance non seulement à l’épaisseur mais aussi à la concentration des absorbeurs dans la solution.
Cette combinaison des travaux de Lambert et Beer a façonné la loi de Beer-Lambert telle que nous la connaissons aujourd’hui, un pilier en chimie analytique qui a évolué significativement au fil des siècles pour devenir un outil fondamental dans l’étude des solutions.
Les fondements théoriques de la loi de Beer-Lambert
Définitions et paramètres clés
La loi de Beer-Lambert repose sur quatre paramètres essentiels pour décrire l’interaction lumière-matière dans une solution.
- L’absorbance (A) quantifie la réduction de l’intensité lumineuse due aux molécules absorbantes.
- Le coefficient d’absorption molaire () est une constante qui indique l’efficacité avec laquelle une substance absorbe la lumière à une longueur d’onde donnée.
- La longueur de chemin optique (), généralement en centimètres, mesure la distance parcourue par la lumière à travers l’échantillon.
- La concentration (c) de la solution est la quantité de substance absorbante présente dans un volume donné.
Ensemble, ces facteurs permettent de calculer l’absorbance selon la formule :
, illustrant ainsi la directe proportionnalité avec la concentration et la longueur du trajet lumineux.
Dérivation de la loi de Beer-Lambert
L’origine de la loi de Beer-Lambert est ancrée dans une approche empirique. Historiquement, les scientifiques ont observé que la lumière perd de son intensité en traversant un milieu absorbant, sans connaître les mécanismes sous-jacents.
Cette observation a conduit à formuler la loi comme une relation linéaire entre l’absorbance et les autres variables. Plus tard, une dérivation fondée sur les principes de transfert radiatif a permis de mieux comprendre et de formaliser mathématiquement cette relation.
En appliquant les lois de la conservation de l’énergie et en modélisant le comportement des photons dans la matière, les chercheurs ont pu exprimer l’absorbance en termes de probabilités moléculaires d’interaction avec la lumière, consolidant ainsi la théorie derrière cette loi empirique.
Cette formulation théorique aide à prédire l’absorption dans des conditions variées, affirmant la loi de Beer-Lambert comme un outil indispensable en science.
Quelles sont les applications de la loi de Beer-Lambert ?
Mesure de l’absorbance
Pour mesurer l’absorbance, un spectrophotomètre joue un rôle central. Cet appareil évalue la quantité de lumière absorbée par une solution.
Il envoie un faisceau de lumière à travers un échantillon et compare l’intensité lumineuse avant et après le passage pour calculer l’absorbance.
Le protocole standard inclut le réglage de la longueur d’onde, le placement de l’échantillon dans la cuve, et la lecture de l’absorbance.
Ces étapes garantissent des mesures précises et reproductibles, essentielles pour des analyses fiables.
Utilisation en chimie analytique
La loi de Beer-Lambert est cruciale pour le dosage par étalonnage. Cette méthode détermine la concentration d’une substance en comparant son absorbance à celle de solutions étalons de concentrations connues.
On trace alors une courbe d’étalonnage pour trouver la concentration inconnue d’un nouvel échantillon. Cette technique est largement utilisée pour analyser des échantillons complexes en laboratoire.
Limites de validité
Bien que très utile, la loi de Beer-Lambert a des limites. Lorsque l’absorbance devient très élevée (généralement supérieure à 1), la relation linéaire entre absorbance et concentration peut ne plus tenir.
De plus, la chimie de la solution peut affecter les mesures. Les effets de matrice, tels que les interactions entre les molécules dans la solution, peuvent altérer l’absorbance et requièrent des ajustements pour maintenir l’exactitude des résultats.
Ces limites doivent être comprises et gérées pour exploiter pleinement la loi dans diverses applications scientifiques.
Les aspects pratiques de la loi de Beer-Lambert
Calibration du spectrophotomètre
Calibrer un spectrophotomètre est essentiel pour assurer la précision des résultats. Cette étape commence par la préparation des solutions étalons, où différentes concentrations connues sont préparées soigneusement.
Ensuite, on utilise ces solutions pour créer une courbe d’étalonnage, essentielle pour interpréter les mesures d’absorbance des échantillons inconnus.
Cette courbe, illustrant la relation entre absorbance et concentration, permet de déterminer précisément la concentration des échantillons testés.
Analyse d’échantillons complexes
L’analyse d’échantillons complexes requiert une attention particulière pour gérer les interférences qui peuvent fausser les mesures. Ces interférences peuvent provenir d’autres substances présentes dans l’échantillon qui absorbent également la lumière.
Pour améliorer la précision des mesures, il est conseillé d’utiliser des techniques de filtrage spectral ou des méthodes de compensation.
Optimiser les paramètres du spectrophotomètre, comme la longueur d’onde, et prétraiter les échantillons pour minimiser les effets des composants non désirés sont d’autres astuces efficaces.
Ces stratégies assurent que la loi de Beer-Lambert soit appliquée avec la plus grande exactitude possible, même dans des conditions expérimentales difficiles.
Les extensions et les limitations
Au-delà de la loi de Beer-Lambert
La loi de Beer-Lambert offre un cadre de base pour la spectrophotométrie, mais elle rencontre des limitations, notamment en présence de hautes concentrations.
Dans ces cas, la relation entre absorbance et concentration devient non-linéaire, ce qui peut entraîner des erreurs de mesure.
De plus, les effets de la diffusion et de la réfraction de la lumière par des particules dans l’échantillon peuvent également altérer les résultats, nécessitant des corrections pour une précision accrue.
Adaptations modernes
Pour surmonter les limites de la loi traditionnelle, les scientifiques ont développé des modèles avancés. Ces modèles incorporent des corrections pour gérer la non-linéarité, la diffusion, et d’autres phénomènes complexes.
Par exemple, certaines adaptations prennent en compte la taille des particules absorbantes ou utilisent des méthodes statistiques pour ajuster les données.
Ces adaptations modernes permettent d’étendre l’application de la loi de Beer-Lambert à des situations où elle ne serait normalement pas applicable, offrant ainsi une flexibilité et une précision améliorées dans l’analyse spectrophotométrique de divers échantillons complexes.
Les implications scientifiques et techniques de la loi de Beer-Lambert
Applications en biochimie et pharmacologie
La loi de Beer-Lambert est essentielle pour doser des médicaments et biomolécules en biochimie et pharmacologie.
Cette loi permet de déterminer précisément les concentrations de substances actives dans des formulations ou des échantillons biologiques, optimisant ainsi les protocoles thérapeutiques et les études de biodisponibilité.
Utilisation dans les sciences environnementales
En sciences environnementales, cette loi joue un rôle clé dans la surveillance de la qualité de l’eau et de l’air. Les spectrophotomètres équipés pour appliquer cette loi détectent et quantifient les polluants et les contaminants.
Cette capacité est cruciale pour le suivi environnemental et aide à garantir la conformité avec les normes de sécurité.
Avancées technologiques
La spectrophotométrie de nouvelle génération intègre des améliorations significatives qui élargissent les capacités de la loi traditionnelle de Beer-Lambert.
Ces appareils avancés offrent une précision accrue, gèrent mieux les échantillons troubles ou colorés, et permettent des analyses plus rapides et plus fiables.
Ces innovations technologiques renforcent l’utilisation de la spectrophotométrie dans la recherche et les applications industrielles, ouvrant la voie à de nouvelles découvertes et améliorations dans divers domaines scientifiques.
Conclusion
La loi de Beer-Lambert est un outil fondamental en spectrophotométrie, reliant l’absorbance d’une solution à sa concentration et à la longueur du trajet lumineux.
Originairement développée pour la chimie analytique, elle trouve des applications étendues en biochimie, pharmacologie, et sciences environnementales. Malgré sa simplicité, elle présente des limites à haute concentration et en présence d’interférences.
La recherche actuelle se concentre sur des innovations pour dépasser ces limites, notamment avec des technologies de spectrophotométrie avancées.
Ces développements promettent d’améliorer la précision et la fiabilité des analyses, ouvrant la voie à de nouvelles découvertes et applications dans de nombreux domaines scientifiques.
La loi de Beer-Lambert demeure un pilier dans la caractérisation des solutions, et son évolution continue à façonner l’avenir de la spectroscopie.




Comments (0)